Tumore della vescica
1. INTRODUZIONE
La vescica è un organo muscolare cavo di forma sferica, situato nell’addome inferiore, all’interno della pelvi, nella sua parte più profonda al davanti del retto (il tratto terminale dell’intestino) e appena di sopra della prostata.
Avendo pareti elastico-muscolari, ha la capacità di trattenere le urine e di espellerle contraendosi.
Il tumore alla vescica è causato dalla trasformazione a carattere maligno delle cellule che si trovano sulla superficie interna dell’organo stesso. In modo particolare, le neoplasie, che hanno forma papillare (piccole papille) possono infiltrare la parete della vescica. Più raramente, invece, le neoplasie assumono forma piatta o nodulare.
Il carcinoma alla vescica è la malattia più frequente che colpisce tale organo; si parla di carcinoma uroteliale (UCC), poiché le neoplasie si formano nell’urotelio, il tessuto epiteliale della vescica urinaria. Nel 95% dei casi il tumore alla vescica si manifesta sotto forma di carcinoma a cellule uroteliali (o “di transizione”); per questo motivo, si parla anche di carcinoma transizionale (TCC), quando ci si riferisce al tumore vescicale.
Esistono altre forme di cancro alla vescica, che risultano essere meno frequenti: l’adenocarcinoma e il carcinoma squamoso primitivo.
Circa il 75% dei pazienti si presenta con neoplasia vescicale a cellule di transizione confinata agli strati superficiali della vescica; nei pazienti di età inferiore a 40 anni, questa percentuale è anche maggiore.
2. DIFFUSIONE
Il tumore della vescica rappresenta circa il 3% di tutte le neoplasie ed è il secondo più frequente in ambito urologico, dopo il tumore della prostata. Colpisce maggiormente la popolazione maschile rispetto a quella femminile e risulta essere più diffuso negli over 60. In base ai dati del Registro dei Tumori, in Italia nell’anno 2018 sono stati diagnosticati 27.000 casi di tumore vescicale, di cui 21.500 tra gli uomini e 5.500 tra le donne.
3. FATTORI DI RISCHIO
Il più importante e correggibile è il fumo di tabacco, per il quale esiste una correlazione diretta con la neoplasia vescicale (50% dei casi). Sigarette a basso contenuto di nicotina non sono associate a rischio minore di sviluppare neoplasia vescicale; il rischio associato al consumo di sigarette elettroniche non è stato adeguatamente valutato.
Un ruolo importante è rivestito dalla esposizione professionale alle amine aromatiche, ovvero sostanze prodotte durante la produzione industriale di vernici, metalli e derivati del petrolio. L’esposizione a questi agenti è causa del 10% dei tumori della vescica. La predisposizione genetica e la familiarità possono influenzare lo sviluppo della patologia neoplastica.
Da ricordare tra i fattori di rischio, anche se raro, l’infezione vescicale da parassiti, come lo Schistosoma haematobium, diffuso in alcuni paesi del Medio Oriente. Infine, l’esposizione a radiazioni ionizzanti è connessa ad un maggiore rischio di tumore vescicale.
4. PREVENZIONE
Ad oggi non sono stati ancora individuati programmi di screening o metodi di diagnosi precoce.
E’ importante modificare le abitudini di vita, cioè smettere di fumare, se si fuma, mangiare in modo sano ed equilibrato (dieta mediterranea), intervenire sulle abitudini lavorative a rischio.
È fondamentale, inoltre, prestare attenzione all'insorgenza di importanti sintomi minzionali irritativi e, in particolare, di sangue nelle urine (ematuria).
5. SINTOMI
L’ematuria (sangue nelle urine) in genere è il primo campanello d’allarme per il tumore vescicale.
La frequenza e l’urgenza urinaria così come la nicturia (risvegli notturni per urinare), anche se più spesso sono da riferire ad un semplice ingrossamento della prostata, possono essere il segnale di un tumore vescicale.
Qualora il tumore si trovi sul collo della vescica, possono verificarsi casi di disuria ostruttiva (difficoltà nella minzione) e di stranguria (flusso di urina intermittente, a gocce).
Quando il tumore è avanzato e infiltra gli sbocchi ureterali, i reni e l’uretere possono dilatarsi, provocando dolori a fianco e schiena paragonabili a quelli delle coliche renali.
6. DIAGNOSI
La diagnosi avviene in genere mediante ecografia addominale a vescica piena e cistoscopia, consigliate in seguito a visita urologica.
La cistoscopia consiste nell’introduzione attraverso l’uretra di uno strumento (cistoscopio) che può essere rigido o flessibile: nel sesso maschile, proprio per ridurre la potenziale dolorabilità provocata dalla strumentazione e consentire un più agevole accesso attraverso l’uretra, si utilizza per lo più lo strumento flessibile. Per eseguire la cistoscopia, è necessario introdurre soluzione fisiologica in vescica, in modo da distendere l'organo. Inoltre, viene inserita una sostanza anestetica nell’uretra al fine di ridurre l’eventuale fastidio. La cistoscopia consente la visualizzazione diretta delle pareti della vescica e quindi la diagnosi di neoformazioni che aggettano dentro il lume della stessa. A completamento e in genere prima di arrivare alla cistoscopia, si consiglia un esame delle urine per la ricerca di cellule neoplastiche (citologia urinaria su 3 campioni).
Se durante la cistoscopia la parete della vescica è liscia e la vescica presenta normali dimensioni, forma e posizione, significa che probabilmente è tutto nella norma. In questo caso, il medico può subito informare il paziente. Al contrario, se viene identificata la presenza di una malattia evidente in vescica, è necessario il successivo ricovero per effettuare la resezione endoscopica della neoformazione vescicale riscontrata alla cistoscopia (trans-urethral resection of bladder, TURB o TURV).
Dopo la cistoscopia, il paziente può sentire dolore all’uretra e lungo il pene e può notare tracce ematiche nelle urine per uno-due giorni. Il medico può prescrivere degli antidolorifici e/o degli antibiotici, se raccomandato, per prevenire possibili infezioni. Si consiglia, in ogni caso, di rimanere a riposo, evitare sforzi fisici o attività sessuale fino alla scomparsa del dolore.
In caso di presenza di tumore della vescica, occorre eseguire anche una TAC addome-pelvi con mezzo di contrasto per studiare l’eventuale diffusione ad altri organi o alle le alte vie escretrici (pelvi renali ed ureteri). La neoplasia della vescica, infatti, trae origine dal rivestimento del viscere (urotelio), che è lo stesso che si trova anche in tutto il sistema escretore, dai calici del rene al bacinetto renale e lungo tutto l’uretere. Essendo una malattia di tutto il rivestimento delle vie urinarie, nel 3-5% dei pazienti con tumore della vescica può concomitare malattia diffusa anche alle alte vie escretrici. La diagnostica strumentale con TAC si rende necessaria proprio per escludere la diffusione della malattia anche in altre sedi dell’asse escretore urinario.
La TAC addome-pelvi rientra comunque sempre nel percorso diagnostico dell’ematuria, anche in caso di negatività della cistoscopia: in questo caso, in assenza di tumore della vescica, la TAC addome-pelvi si esegue proprio per escludere neoplasia uroteliale negli altri distretti o un tumore del rene che ha infiltrato la via escretrice dall'esterno, provocandone il sanguinamento.
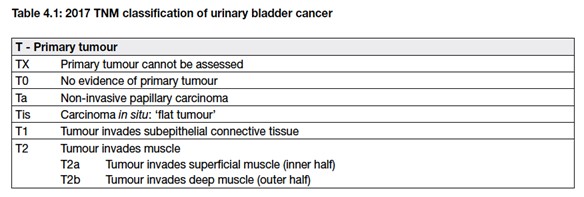
7. CLASSIFICAZIONE DEL TUMORE VESCICALE
Nel 95% dei casi i tumori della vescica derivano dell’epitelio di transizione, sono pertanto carcinomi transizionali (o uroteliali): possono essere di forma papillare o piatti e possono essere infiltranti o non infiltranti. Il tumore della vescica si distingue in:
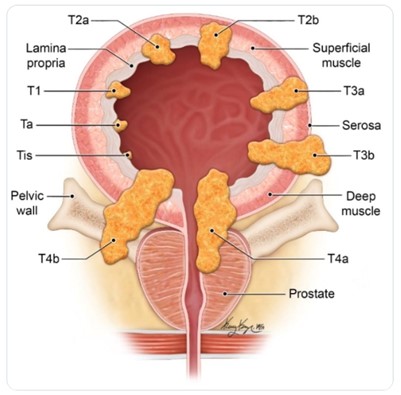
- non muscolo-invasivi, nei quali la malattia è confinata alla tonaca mucosa, stadi Ta e Tis secondo la classificazione TNM, o alla sottomucosa, stadio T1 secondo TNM
- muscolo-invasivi, nei quali la neoplasia ha invaso o superato la tonaca muscolare (stadi T2-T4 secondo TNM)
Oltre alla classificazione TNM (Tabella 1), i carcinomi della vescica vengono classificati in gradi utilizzando i criteri della WHO (World Health Organization – Organizzazione Mondiale della Sanità) del 1973, aggiornati nel 2004. Nella Figura 2 si mostra il grado di infiltrazione del tumore nella parete vescicale.
La classificazione più recente introduce la neoplasia papillare uroteliale a basso grado di potenzialità maligna (PUNLMP), che istologicamente si caratterizza per l’assenza di aspetti citologici di malignità mostrando cellule di aspetto normale ma con configurazione papillifera.

Molto più raramente, nella vescica si verificano carcinomi squamosi o adenocarcinomi.
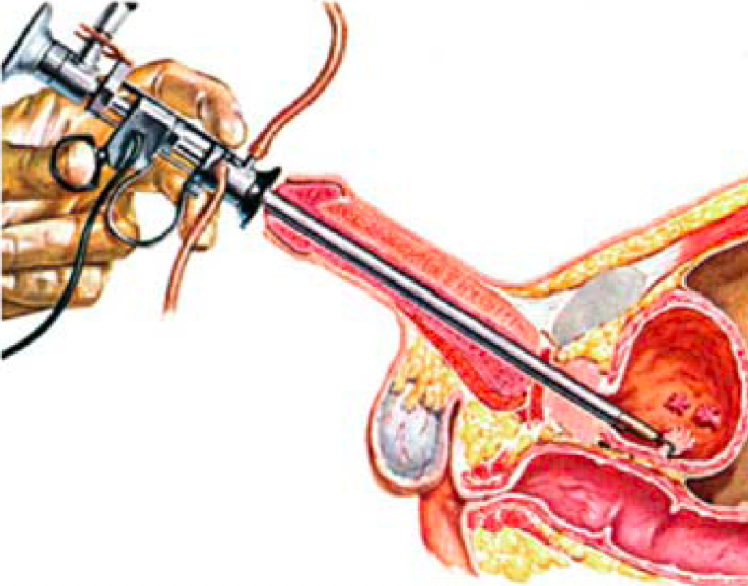
8. RESEZIONE ENDOSCOPICA DI NEOFORMAZIONE VESCICALE (TURV O TURBT)
La TURV o resezione transuretrale della vescica è una procedura endoscopica che ha la finalità di asportare neoformazioni presenti sulla parete vescicale e/o ottenerne una valutazione anatomo-patologica.
La resezione del tessuto vescicale tramite TURV consente di verificare la reale presenza di malattia: ci sono infatti alcuni casi in cui forme di cistite o altra infiammazione possono mimare la presenza di un tumore, che in realtà non viene confermato. Se la malattia è realmente presente, la TURV consente di verificarne l’estensione e le caratteristiche.
8.1 Tecnica chirurgica della TURV
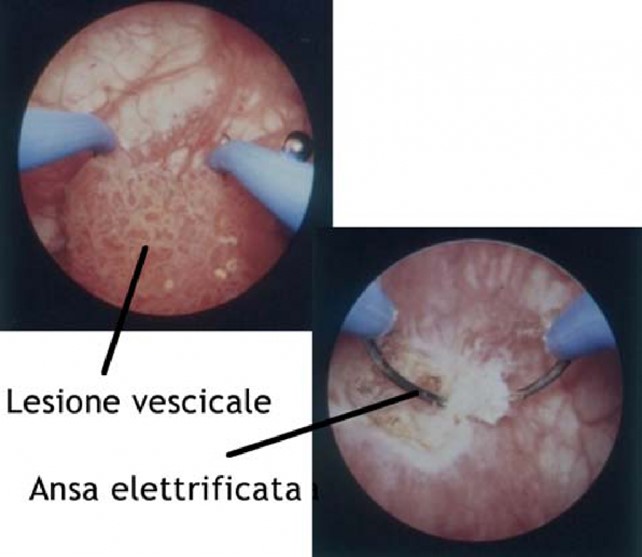
Il paziente è in posizione supina ed ha le gambe rialzate sostenute da gambali. Uno strumento chiamato “resettore” viene introdotto (Figura 2) attraverso l’uretra e raggiunge la cavità vescicale che viene distesa con soluzione irrigante.
Le lesioni e/o neoplasie vescicali vengono rimosse con l’uso di anse da resezione che portano la corrente di un elettrobisturi (Figura 3); tali anse scorrendo dentro la lesione la asportano a fette dalla sommità fino alla base (resezione). Completata l’asportazione delle lesioni vescicali, si procede alla coagulazione delle aree di resezione per l’emostasi. L’intervento si conclude spesso con il posizionamento di un catetere vescicale a 3 vie per il lavaggio continuo della vescica (cistoclisi); la fuoriuscita di liquido di lavaggio chiaro è indice di una buona emostasi. La durata dell’intervento varia da 10 minuti a 90 minuti, talora anche oltre, in rapporto al numero e alle dimensioni delle lesioni o neoformazioni da asportare. L’intervento può essere eseguito in anestesia spinale o generale.
8.2 Benefici attesi e probabilità di successo e insuccesso
L’intervento permette di risolvere la macroematuria (sangue nelle urine) e l’asportazione della neoformazione che causa l’eventuale sanguinamento. Possono essere asportate in maniera radicale neoformazioni non infiltranti la parete vescicale (Ta/T1). Il materiale asportato verrà analizzato dall’anatomopatologo, che fornirà informazioni indispensabili per il proseguimento delle cure.
8.3 Rischi connessi con l'intervento
- Perforazione vescicale: può essere extraperitoneale, ed essere risolta con il semplice cateterismo, o intraperitoneale; in quest’ultimo caso, se la perforazione è ampia, può essere necessaria una riparazione chirurgica
- Emorragia: in caso di sanguinamento persistente, potrebbe essere necessario un intervento endoscopico in urgenza per fare emostasi, ovvero coagulare le aree sanguinanti
- Lesione dell’uretere: possibile quando la lesione riveste il suo sbocco in vescica (meato); talvolta può essere necessario porre un cateterino all'interno di uretere, meato e vescica, per favorirne la guarigione
- Lesione dell’uretra: quasi sempre risolvibile con il solo cateterismo; in alcuni casi posso residuare restringimenti (stenosi) del canale uretrale
- Sindrome da riassorbimento dei liquidi: è una complicanza molto rara, dovuta al riassorbimento dei liquidi utilizzati durante l’intervento e che può portare a complicanze quali l’edema polmonare, l’insufficienza renale e l’edema cerebrale
- Infezioni delle vie urinarie o genitali (specialmente orchiepididimite, cistite e prostatite)
8.4 TURV di completamento
Dopo una TURV eseguita per neoplasia anche in stadio Ta/T1, esiste comunque un rischio di malattia residua. Il rischio di persistenza di tumore dopo un riscontro di neoplasia Ta/T1 di alto grado (HG) è del 51-58%, anche per intervento apparentemente completo con presenza di tonaca muscolare nel prelievo. Esiste poi il rischio di sottostima del tumore T1, che varia dal 8% al 11%: questo significa che ad un tumore muscolo-invasivo viene attribuito uno stadio più basso e meno aggressivo.
Per questi motivi, viene spesso indicata una seconda resezione endoscopica (“TURV di completamento” o “second look”, o “re-TURV”) dopo un primo intervento di TURV. Oltre ad una migliore stadiazione, sottoporsi ad una TURV di completamento diminuisce la possibilità di recidiva e migliora i risultati dei trattamenti endocavitari con BCG (vedi oltre); alcuni studi dimostrano che una TURV second look dopo un tumore in stadio T1 HG migliora proprio la sopravvivenza libera da progressione di malattia. In genere, la TURV di completamento viene eseguita 4-6 settimane dopo la prima TURV.
La TURV second look viene indicata in caso di tumori in stadio T1 alla prima TURV, in caso di prima TURV incompleta e in assenza di tonaca muscolare nel campione della prima TURV per tumori TaHG.
8.5 Cosa succede dopo la TURV?
A seguito dell'intervento chirurgico, quando il liquido di lavaggio vescicale risulta persistentemente chiaro, si interrompe. Se la resezione è stata superficiale, si può rimuovere il catetere vescicale anche il giorno seguente o due giorni dopo la TURV. Se, al contrario, la resezione è stata profonda, si preferisce mantenere in sede il catetere vescicale per qualche giorno in più. Solitamente, la degenza ospedaliera dopo questo intervento è in media di 1-2 giorni.
Il paziente deve rimanere poi in attesa dell'esito dell'esame istologico del materiale prelevato in occasione della TURV o della re-TURV: la strategia terapeutica successiva sarà valutata in base alle caratteristiche del paziente, del tumore vescicale e sull’andamento della malattia; sarà compito dell’urologo valutare i fattori di rischio ed il migliore trattamento da utilizzare.
Le Linee Guida Europee raccomandano l’utilizzo di EAU Risk Group Calculator per assegnare ad ogni paziente una classe di rischio (Figura 4).


Il tumore della vescica viene cosi stratificato in 4 classi di rischio.
Una malattia superficiale, piccola, di basso grado e non recidivante potrà essere controllata da una singola TURV, anche associata ad una immediata instillazione endovescicale post-operatoria con farmaco chemioterapico. A questa dovrà seguire un rigoroso follow up per verificare l’assenza di recidive successive della malattia.
Per i tumori a rischio intermedio o alto (“intermediate and high risk”), verrà posta indicazione a trattamento endovescicale con BCG.
Per i tumori a rischio molto alto (“very high risk”) verrà offerto l’intervento di cistectomia radicale, ovvero l’asportazione radicale della vescica. Solo per i pazienti che rifiutano l’intervento o che non sono candidabili per fragilità (pazienti con multiple malattie associate che controindicano un intervento chirurgico di tale portata) verrà indicato un ciclo completo di instillazioni con BCG per 1-3 anni. Occorre ricordare come in questi pazienti a rischio molto alto il rischio di progressione di malattia sia del 44% a 5 anni e 59% a 10 anni.
Per i tumori con infiltrazione della tonaca muscolare, verrà posta indicazione ad intervento di cistectomia radicale.
9. INSTILLAZIONI CON BCG
Dopo la TURV o la re-TURV, se il tumore della vescica è a rischio intermedio o alto, verrà posta indicazione ad eseguire trattamento endovescicale con BCG.
Le instillazioni endovescicali prevedono la somministrazione in vescica, mediante un catetere vescicale di piccolo calibro, di un farmaco immunoterapico ( BCG - Bacillus Calmette Guerin ) secondo un programma terapeutico ben definito; tale farmaco introdotto in vescica stimola una reazione immunitaria locale che contrasta o limita la recidiva del tumore vescicale. La procedura non è di per se dolorosa, il fastidio è legato all’introduzione del catetere in vescica. La durata della procedura è di qualche minuto.
La terapia endovescicale inizia circa 30 gg dopo la TURV; prevede una prima fase di induzione di n°6 instillazioni endovescicali ambulatoriali con cadenza settimanale e, a seguire, cicli di mantenimento secondo programma, che prevederanno cistoscopie ambulatoriali periodiche di controllo.
In alternativa alle instillazioni endovescicali con BCG, esistono instillazioni con farmaci chemioterapici (mitomicina, epirubicina), consigliati in caso di controindicazione o reazione avversa al BCG. Rispetto le instillazioni con chemioterapici, le instillazioni con BCG di mantenimento migliorano la risposta completa di malattia, riducono il rischio di progressione del tumore e aumentano la quota di pazienti che rimangono disease-free (cioè senza malattia).
10. CISTECTOMIA RADICALE
La cistectomia è l’intervento chirurgico radicale che comporta la rimozione della vescica e dei linfonodi regionali.
Nell’uomo, contestualmente alla vescica vengono asportate la prostata e le vescicole seminali; nella donna, può venire associata l’asportazione dell’utero e delle ovaie anche se queste opzioni vengono valutate caso per caso anche in base al tipo di derivazione urinaria realizzata.
Dopo la rimozione della vescica è infatti necessario derivare le urine, ovvero realizzare una nuova canalizzazione del tratto urinario per permettere all’urina di fuoriuscire dall’organismo senza la presenza della vescica.
Si distinguono quindi:
- Ureterocutaneostomia: dopo aver rimosso la vescica, gli ureteri - i due condotti che portano l’urina dal rene alla vescica – vengono anastomizzati ovvero congiunti e suturati direttamente alla cute dell’addome separatamente. Questo comporta la realizzazione di due stomie. Questa derivazione è la più rapida e semplice e viene spesso indicata per pazienti molto fragili o qualora ci sia la necessita di ridurre al minimo i tempi operatori. Al termine dell’intervento, all’interno delle due stomie saranno collocati dei cateterini ureterali che saranno sostituiti ogni 30-35 giorni ambulatorialmente.
- Ureteroileocutaneostomia o condotto ileale (Bricker/Wallace): è una delle derivazioni più utilizzate nel mondo; viene utilizzato un segmento di intestino di circa 10-15 cm al quale vengono collegati gli ureteri. Il segmento ileale viene suturato alla cute nella parte inferiore destra dell’addome. Si realizza cosi una singola stomia, sulla quale viene posizionato un dispositivo per la raccolta delle urine. Il vantaggio rispetto il semplice abbocco degli ureteri all’addome (ureterocutaneostomia) è la presenza di una singola stomia, l’assenza di necessita di cateterini ureterali ma soprattutto la presenza del segmento intestinale interposto, che funge da barriera fra le vie urinare e l’esterno, limitando le possibili infezioni.
- Neovescica (vescica ortotopica): viene creata una nuova vescica utilizzando circa 40-50 cm di tessuto ileale (neovescica ileale). Il segmento intestinale viene modellato in modo da creare un sacchetto di forma simil-sferica a bassa pressione che viene collegata all’uretra e agli ureteri, al fine di consentire al paziente di urinare dall’uretra. E’ senza dubbio la derivazione urinaria più complessa più spesso realizzata in centri ad alto volume chirurgico.
La valutazione del tipo di derivazione urinaria spetta al chirurgo e viene discussa con il paziente in fase pre-operatoria. La decisione si basa sul tipo di malattia vescicale e sulle condizioni cliniche del paziente; anche la qualità di vita del paziente, le condizioni sociali e le sue aspettative giocano un ruolo importante e vengono considerate nella scelta della derivazione urinaria.
Tradizionalmente la cistectomia veniva eseguita in modalità a cielo aperto (open); l’intervento a cielo aperto comportava un’incisione piuttosto ampia e poteva essere gravato da un certo grado di morbidità post-operatoria, come necessita di emotrasfusioni o complicanze trombo-emboliche, nonché da tempi di degenza e tempi di recupero piuttosto lunghi.
10.1 Cistectomia robotica
La rapida espansione della chirurgia robotica e l’esperienza maturata con la prostatectomia radicale hanno comportato una rapida transizione a chirurgia robotica anche per l’intervento di cistectomia radicale per tumore della vescica. Numerosi studi confermano l’equivalenza della chirurgia robotica rispetto la chirurgia a cielo aperto in termini di efficacia oncologica nel controllo della malattia (radicalità) sia a breve che a lungo termine. Tra questi, da citare è lo studio del gruppo di Parekh, pubblicato su Lancet nel 2018.
In sala operatoria, il paziente viene posizionato in maniera idonea sul lettino e sottoposto ad anestesia generale. Vengono eseguite 5 incisioni di circa 1-2 cm a livello della parete addominale e un'incisione sopra l'ombelico di circa 4 cm, per consentire l'asportazione del pezzo operatorio. Si procede ad insufflare la cavità addominale del paziente con la CO2, in modo da creare una camera di lavoro, e introducono i trocar, strumenti simili a cannucce che consentono la comunicazione tra l'esterno e l'interno dell'organismo del paziente. Si procede, pertanto, al posizionamento della telecamera tridimensionale, degli strumenti robotici e laparoscopici. Il chirurgo, attraverso la console, manovra i bracci robotici, isola e rimuove la vescica insieme a prostata e vescicole seminali nell'uomo, ed eventualmente di utero, ovaie e parte della vagina nella donna. Si procede, inoltre, alla rimozione dei linfonodi loco-regionali, con uno scopo sia terapeutico che di stadiazione, ovvero per comprendere se sono necessarie ulteriori terapie in aggiunta all'intervento chirurgico. Una volta rimossi i pezzi operatori, che vengono inviati in anatomia patologica per l'esecuzione dell'esame istologico definitivo, il chirurgo esegue la fase ricostruttiva, optando, a seconda dei casi, per una delle tre possibilità sopra menzionate.
Quali vantaggi fornisce la chirurgia robotica? Gli elementi di maggior rilievo sono una visualizzazione in 3 dimensioni del campo operatorio, la magnificazione dell’immagine, una migliore manovrabilità degli strumenti chirurgici rispetto alla laparoscopia tradizionale e il maggiore grado di movimento rispetto alla mano umana con una maggiore precisione.
Queste caratteristiche rendono la chirurgia robotica particolarmente utile per l’intervento di cistectomia radicale: i vantaggi della robotica sono evidenti sia nella fase di asportazione della vescica, laddove la dissezione chirurgica deve arrivare fino all’uretra (struttura localizzata molto in profondità), sia nella fase di ricostruzione della derivazione urinaria, in quanto lo strumento consente di realizzare con maggiore precisione e rapidità numerose e complesse suture.
La chirurgia robotica consente infatti di realizzare la derivazione urinaria per via completamente intra-corporea, senza necessità di ampliare le incisioni. Questo comporta una rapida ripresa post-operatoria, diminuendo i tempi di canalizzazione a gas e feci, i tempi di mobilizzazione, la degenza post-operatoria complessiva.
Un recente studio pubblicato sulla rivista Jama ha mostrato come la cistectomia robotica con derivazione intra-corporea riduca in maniera significativa la necessita di trasfusione, la percentuale di complicanze a carico della ferita chirurgica (dal 16% a cielo aperto a 5% con robotica), la percentuale di complicanze trombo-emboliche (dal 9% a cielo aperto a 1% con chirurgia robotica). Nello studio, i pazienti sottoposti a chirurgia a cielo aperto riportavano una peggiore qualità della vita a 5 settimane dall’intervento ed un maggiore grado di disabilita a 5 e 12 settimane. Nello studio pubblicato su Jama, la derivazione intra-corporea di maggiore utilizzo era il condotto ileale, mentre la neovescica veniva utilizzata nell’10-12% dei pazienti.
Catto JWF, Effect of Robot-Assisted Radical Cystectomy vs Open Radical Cystectomy on 90-Day Morbidity and Mortality Among Patients With Bladder Cancer-Reply. JAMA. 2022 Sep 27;328(12):1258-1259. doi: 10.1001/jama.2022.13600.
10.2 Personale esperienza con la cistectomia robotica
Nella personale esperienza di chirurgia robotica, mi sono sempre dedicato allo studio della cistectomia robotica seguendone dapprima l’introduzione e la rapida diffusione.
Laddove indicata l’esecuzione della neovescica, la tecnica di ricostruzione robotica che utilizzo è quella ideata a Bordeaux dal Prof. Gaston; la tecnica consente la realizzazione di una neovescica a bassa capacità e di relativa semplice esecuzione, con anastomosi (sutura) separata dei due ureteri al neoserbatoio.
Ho personalmente messo a punto un dettaglio di tecnica – la ricostruzione posteriore – volto a semplificare la realizzazione della neovescica, in particolare la sua discesa in scavo pelvico e la sutura con l’uretra. Questa tecnica promette anche di migliorare la continenza urinaria della neovescica, nonché di garantirle maggiore fissità e quindi una migliore disposizione nella piccola pelvi.
I risultati della mia personale casistica insieme a video di tecnica chirurgica sono stati presentati in convegni internazionali (European Association of Urology 2022 e American Urological Association 2022) e saranno imminente oggetto di pubblicazione. In particolare, nella mia personale esperienza ho utilizzato la neovescica come derivazione urinaria in quasi 50% dei pazienti sottoposti a cistectomia robotica. Qualora il paziente di sesso maschile desideri continuare ad avere una attività sessuale, utilizzo la tecnica nerve sparing che comporta la conservazione dei fasci vascolo-nervosi deputati all’erezione. Nella donna, in caso di realizzazione di neovescica, utilizzo il risparmio dell’utero e della vagina, per garantire maggiore fissità al neoserbaio, migliore possibilità di ripresa della dinamica minzionale, possibilità di conservazione dell’attività sessuale.
Rocco B, Sighinolfi MC. Re: James W.F. Catto, Pramit Khetrapal, Federico Ricciardi, et al. Effect of Robot-assisted Radical Cystectomy with Intracorporeal Urinary Diversion vs Open Radical Cystectomy on 90-Day Morbidity and Mortality Among Patients with Bladder Cancer: A Randomized Clinical Trial. JAMA 2022;327:2092-103. Eur Urol. 2022
Sighinolfi MC, Rocco B et al . Robotic assisted radical cystectomy: insights on long term oncological outcomes from the International Robotic Cystectomy Consortium. Transl Androl Urol. 2019
Moschovas MC, Sighinolfi MC, Rocco B, Coelho RF.et al. Robotic-assisted radical cystectomy: the first multicentric Brazilian experience. J Robot Surg. 2020
Sighinolfi MC, Rocco B, et al. Re: Accurate Quantification of Residual Cancer Cells in Pelvic Washing Reveals Association with Cancer Recurrence following Robot-Assisted Radical Cystectomy. Micali S, Bianchi G.J Urol. 2019 Dec;202(6):1271-1272. doi: 10.1097/JU.0000000000000481. Epub 2019 Aug 8.PMID: 31393813
Rocco B, Wiklund P. et al. Posterior reconstruction during robotic-assisted radical cystectomy with intracorporeal orthotopic ileal neobladder: description and outcomes of a simple step. J Robot Surg. 2021
