Tumore della prostata
Il tumore della prostata è la neoplasia più diffusa negli uomini over-50 e, nella maggioranza dei casi, progredisce senza causare nessun disturbo urinario. È fondamentale impostare un percorso di prevenzione insieme all’urologo di fiducia, per identificare l’eventuale presenza di tumore della prostata quando ancora in fase iniziale e per impostare il miglior piano di cure per ciascun paziente. Se indicata, l’esecuzione di prostatectomia radicale robotica garantisce l’asportazione della prostata affetta da neoplasia, garantendo un rapido recupero e preservando, laddove possibile, funzionalità erettile e continenza urinaria.
1. Epidemiologia
Il tumore della prostata è la neoplasia più diffusa nell’uomo dopo i 50 anni: in Italia nel 2020 sono state registrate oltre 36.000 nuove diagnosi di tumore della prostata e più di mezzo milione di uomini convivono con la patologia. Il tumore della prostata rappresenta il 18,5% di tutti i tumori maschili e si segnala un aumento del 3,4% medio annuo dell’incidenza di tumore della prostata negli uomini sotto i 50 anni di età (AIOM). Nel corso della vita, 1 uomo su 8 rischia di sviluppare una neoplasia prostatica e, nel sesso maschile, il tumore della prostata rappresenta la terza causa di morte per cause tumorali (7,7% dei totali decessi oncologici): 7.700 morti nel 2017 in Italia. In Europa i nuovi casi registrati nel 2020 sono 473.000 (EAU) e i decessi oltre 108.000. La American Cancer Society riporta una nuova diagnosi di tumore prostatico ogni 2.7 minuti ed un decesso per tumore prostatico ogni 16 minuti (Figura 1).

2. Sintomatologia
Nella maggior parte dei casi il tumore della prostata non da sintomi specifici. Circa il 70% delle neoplasie origina dalla porzione posteriore della ghiandola, lontano dall’uretra, per cui durante l’accrescimento in genere il paziente non avverte sintomi ostruttivi o altri disturbi urinari. Alterazioni della minzione (getto urinario scadente, attesa e gocciolamento minzionale, sensazione di incompleto svuotamento) sono sintomi più tipicamente associati alla crescita benigna della ghiandola (iperplasia prostatica benigna) che si sviluppa fisiologicamente con l’avanzare dell’età.
3. Diagnosi
La visita urologica e il dosaggio del PSA sono le basi per la diagnosi precoce.
Il PSA (antigene prostatico specifico) è un enzima prodotto esclusivamente dalla prostata, dosabile nel sangue attraverso un semplice prelievo ematico.
Non è un marcatore specifico per il tumore: un modico aumento può essere riscontrato anche a seguito di un’infiammazione della prostata, come nel caso di infezioni delle vie urinarie (es. prostatiti), di una recente manovra urologica (esplorazione rettale, posizionamento di catetere vescicale, ecc) o per condizioni fisiologiche come un’eiaculazione avvenuta a breve distanza dall’esecuzione del prelievo.
Proprio per questo motivo, non esiste un limite definito oltre il quale sicuramente troviamo tumore e sotto il quale viceversa siamo sicuri di poterlo escludere. Il PSA e le sue variazioni nel tempo devono essere valutati dall’urologo il quale, integrando il valore del PSA con visita ed esplorazione rettale, valuterà l’effettivo rischio del paziente di essere affetto da tumore prostatico.
3.1 Quando cominciare a controllare la salute della prostata?
Le Linee Guida Europee raccomandano l’esecuzione del dosaggio del PSA agli uomini di età maggiore ai 50 anni (Figura 2). Questo limite si abbassa a 45 anni per gli uomini di etnia afro-americana o con familiari di primo grado affetti da questo tipo di neoplasia; recenti studi suggeriscono l’esecuzione del PSA a 40 anni negli uomini portatori di mutazioni note del gene BRCA2. A seguire, la cadenza dei controlli verrà stabilita dall’urologo in base all’età, al valore riscontrato e alla cinetica dei valori rilevati nel tempo. In generale, per uomini con primo riscontro di PSA > 2 ng/ml a 60 anni di età, viene richiesto il dosaggio periodico dell’esame ogni 2 anni. Ogni caso deve essere comunque valutato dall’urologo e adattato al singolo paziente.

3.2 PSA, diagnosi precoce e screening: cosa occorre sapere?
L’introduzione del PSA a partire dagli anni ’90 ha comportato nei decenni un aumento delle diagnosi di tumore ed un certo grado di diminuzione della mortalità correlata. Un tempo, infatti, il tumore della prostata veniva diagnosticato per i sintomi che provocava, legati o all’accrescimento locale della malattia o alle metastasi a distanza, per lo più ossee. All’insorgenza della sintomatologia spesso corrispondeva un quadro già avanzato e minori possibilità di cura.
Tuttavia, l’utilizzo non controllato del PSA ha comportato anche la diagnosi di tumori poco aggressivi, di dimensioni esigue e a basso rischio di accrescimento. L’eccesso di diagnosi di tumori non clinicamente significativi (overdiagnosis) può comportare il rischio di eccesso di trattamento (overtreatment) con i potenziali effetti avversi derivanti del trattamento del tumore.
Per questo motivo, in alcuni paesi come gli Stati Uniti, le raccomandazioni sull’utilizzo del PSA si sono allentate a partire dal 2008. A seguire, si è però registrato un nuovo aumento dei casi di tumore diagnosticato in fase più avanzata, in particolare modo pazienti che si presentano con metastasi a distanza
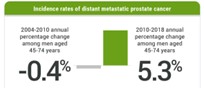
Figura 1: Aumento annuo delle neoplasie diagnosticate in fase metastatica.
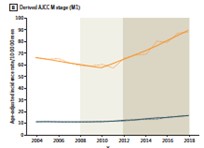
Figura 2: aumento delle neoplasie diagnosticate in fase metastatica (arancione) dopo il 2012.
Link ad articolo da cui sono tratte le figure
Desai MM, Cacciamani GE, Gill K, et al. Trends in Incidence of Metastatic Prostate Cancer in the US. JAMA Netw Open. 2022;5(3):e222246. doi:10.1001/jamanetworkopen.2022.2246
Insieme al gruppo diretto dal Dott. Patel del Global Robotic Institute (Florida), uno dei maggiori esperti internazionali nella terapia chirurgica del tumore prostatico, abbiamo pubblicato i dati relativi all’aumento di diagnosi di tumori più aggressivi proprio dopo le raccomandazioni contro il PSA occorse negli Stati Uniti nel 2008-2012, segnale che l’attenzione verso la diagnosi precoce di tumore della prostata non deve in alcun modo diminuire. È necessario precisare che a malattie in stadio più avanzato corrispondono trattamenti più aggressivi e gravati da un rischio maggiore di sviluppare effetti collaterali nel tentativo di perseguire la cura completa del tumore (radicalità oncologica). Presso il Global Robotic Institute è stato documentato che, dopo il periodo 2008-2012, all’aumentare della quota di interventi per tumori prostatici più avanzati, è corrisposto un peggioramento del risultato funzionale dei pazienti sottoposti ad intervento chirurgico (minore possibilità di recupero della continenza e dell’erezione per combattere radicalmente tumori prostatici aggressivi). (Figura)
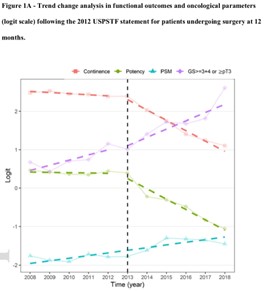
Figura: minore possibilità di recupero della continenza (linea rossa) e dell’erezione (linea verde) per combattere radicalmente tumori prostatici sempre più aggressivi (linea viola), aumentati di numero dopo le raccomandazioni contro l’utilizzo del PSA.
Rocco B, Sighinolfi MC, Coelho RF, Covas Moschovas M, Patel V.Re: Trends in Incidence of Metastatic Prostate Cancer in the US. Eur Urol. 2022 Sep;82(3):332-333. doi: 10.1016/j.eururo.2022.04.023
Onol FF, Rocco B, Patel V. Changing clinical trends in 10 000 robot-assisted laparoscopic prostatectomy patients and impact of the 2012 US Preventive Services Task Force's statement against PSA screening. BJU Int. 2019 Dec;124(6):1014-1021. doi: 10.1111/bju.14866.
Seetharam B, Rocco B, Patel V. Trends in clinical and oncological outcomes of robot-assisted radical prostatectomy before and after the 2012 US Preventive Services Task Force recommendation against PSA screening: a decade of experience. BJU Int. 2020 Jun;125(6):884-892. doi: 10.1111/bju.15051.
Ad oggi le Linee Guida Europee raccomandano di mettere in atto una “strategia personalizzata per la diagnosi precoce”, valutata durante la visita urologica in base al rischio del singolo paziente di sviluppare neoplasia prostatica. Occorre quindi informare gli uomini riguardo i benefici e i rischi del dosaggio del PSA come strumento diagnostico e mettere in atto strategie mirate sul singolo paziente.

In questo scenario, la corretta informazione rappresenta la chiave della diagnosi precoce. La sensibilizzazione rivolta all’uomo sano - ma a rischio di sviluppare neoplasia prostatica - rappresenta l’obiettivo perseguito da associazioni come Europa Uomo Europa ed Europa Uomo Italia.

3.3 Visita urologica: in cosa consiste?
Durante la visita urologica, lo specialista raccoglie l’anamnesi, ovvero le informazioni cliniche sul paziente: eventuali malattie di rilievo in famiglia, patologie in atto, interventi chirurgici eseguiti nel passato, rilevazione di eventuali sintomi urinari attuali. L’urologo poi visita il paziente: la visita consiste nel controllo dell’addome, dei genitali esterni e nell’esplorazione della prostata. La prostata, per la sua sede profonda nello scavo pelvico, si apprezza con la digito-palpazione dal retto: la procedura non è invasiva, dura pochi secondi, e deve essere considerata come momento indispensabile per la salvaguardia della salute del paziente.
3.4 Approfondimenti e procedure diagnostiche consigliate in caso di sospetto tumore prostatico
Se l’urologo rileva il rischio di tumore, o durante l’esplorazione rettale o per il solo PSA alterato, il paziente viene indirizzato ad ulteriori accertamenti quali la risonanza magnetica multiparametrica della prostata (mpMRI) e/o la biopsia prostatica.
Il ruolo della mpMRI è quello di fotografare la prostata - acquisendone immagini mediante scansioni da diverse angolazioni - e di fornire la mappatura delle eventuali zone a rischio di tumore. In caso queste ultime siano presenti e fortemente sospette, l’urologo provvederà alla biopsia mirata di queste aree, per aumentare la possibilità di diagnosticare selettivamente i tumori più aggressivi. Accanto ai prelievi mirati, l’urologo procederà comunque con la mappatura bioptica di tutta la prostata, per non perdere eventuali aree neoplastiche in zone non sospette all’imaging.
In caso di mpMRI negativa e persistente sospetto di tumore, in genere per valori elevati di PSA, il paziente sarà sottoposto a biopsie prostatiche sistematiche, solitamente eseguite in ambulatorio. Si può, talvolta, decidere di procedere direttamente con le biopsie prostatiche sistematiche, senza dover prima eseguire una mpMRI, specialmente nei casi in cui il rischio di presenza di tumore prostatico è particolarmente concreto.
4. Trattamento
4.1 Indicazioni al trattamento attivo
Le indicazioni al trattamento del tumore attivo del tumore sono valutate in base al rischio di aggressività (EAU Risk Grouping). La neoplasia prostatica si suddivide in rischio basso, intermedio, elevato, in base al PSA, al grado isto-patologico (Gleason Score/ISUP) ed alla stadiazione locale.
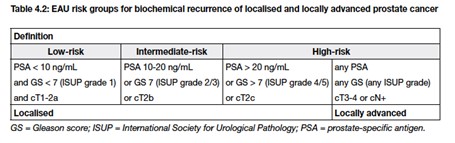
L’intervento chirurgico di prostatectomia radicale è indicato per pazienti con neoplasia a rischio intermedio che abbiano una aspettativa di vita superiore ai 10 anni. La prostatectomia radicale viene altresì indicata nei pazienti con tumore a basso rischio che non siano candidabili a sorveglianza attiva o che desiderino l’intervento chirurgico e ne accettino i potenziali effetti collaterali. Infine, la prostatectomia radicale trova indicazione anche per i pazienti con neoplasia a rischio elevato o localmente avanzata: in questi casi, la chirurgia fa parte di un potenziale trattamento multimodale del tumore che potrà vedere coinvolte anche la radioterapia ed il trattamento medico.
4.2 La prostatectomia radicale
La prostatectomia radicale consiste nell’asportazione della prostata e delle vescicole seminali, al fine di garantire la completa asportazione del tumore e quindi la radicalità oncologica. Tale intervento viene proposto sia per i tumori contenuti all’interno della prostata (tumore organo-confinato), sia spesso anche per quelli che si estendono oltre la capsula prostatica (tumore localmente avanzato) o che sembrano coinvolgere i linfonodi loco-regionali.
Anatomicamente, la prostata è attraversata dall’uretra, l’ultima parte delle vie urinarie, che consente l’emissione all’esterno dell’urina dalla vescica. Per poter isolare e asportare integralmente prostata e vescicole seminali, è necessario incidere il collo vescicale a monte della ghiandola e l’uretra a valle della stessa. Questo processo comporta l’abbattimento delle strutture di supporto muscolo-fasciali che circondano l’uretra, deputate alla continenza dell’urina, e la successiva riconfigurazione della continuità dell’apparato urinario mediante sutura (anastomosi) fra la vescica e la porzione dell’uretra rimanente a livello distale (Figura 1). Ne consegue che uno degli effetti avversi più noti e comuni dell’intervento di prostatectomia radicale è l’incontinenza urinaria, per lo più “da sforzo” (scatenata da quegli sforzi fisici che comportano aumento della pressione endoaddominale).
Nelle manovre di dissezione della prostata, bisogna prestare particolare attenzione al ruolo dei fasci neuro-vascolari, che circondano la ghiandola decorrendo sulla superficie postero-laterale della stessa e sono responsabili del meccanismo dell’erezione. La decisione riguardo la conservazione dei fasci neuro-vascolari, o la loro eventuale asportazione, dipende sia dalla strategia chirurgica che si intraprende, sia dall’abilità e dall’esperienza del chirurgo che esegue tale manovra. Se il chirurgo intende conservare queste strutture, la dissezione correrà rasente la capsula prostatica, “sbucciando” la prostata al fine di preservare al massimo il tessuto funzionale (prostatectomia nerve-sparing). La tecnica nerve-sparing è indicata in caso di tumore a ridotta aggressività e confinati all’interno della prostata, senza cioè affiorare a livello della sua superficie (capsula). Se, viceversa, il tumore si estende oltre la capsula o è costituito da elementi cellulari particolarmente aggressivi, la dissezione chirurgica deve essere più estesa per garantire la completa bonifica da tessuto tumorale, comportando l’asportazione dei fasci vascolo-nervosi e quindi deficit dell’erezione. Al contrario, in caso di prostatectomie nerve-sparing, le chance di recupero, almeno in parte, della funzionalità erettile, sono considerevolmente aumentate.
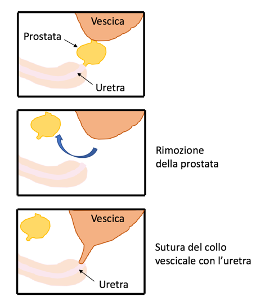
Cosa comporta la prostatectomia radicale robotica?
L’intervento di prostatectomia radicale rappresenta un trattamento attivo per la neoplasia prostatica. L’intervento è stato descritto per la prima volta nel 1904; con l’evolversi della tecnologia, oggi la prostatectomia radicale viene eseguita per via robot-assistita in più dell’80% dei casi, consentendo di ridurre al minimo l’invasività dell’intervento, la durata della degenza e l’impatto sul paziente. Tuttavia, come spesso viene ricordato, non è un robot che esegue l’intervento.
Nella chirurgia robotica, il chirurgo siede ad una console dotata di un monitor, dalla quale comanda il movimento dei bracci robotici, dotati di tutti gli strumenti chirurgici tradizionalmente utilizzati per l’intervento.
I vantaggi della chirurgia robotica consistono nella visione tridimensionale, con un’immagine più ferma rispetto la laparoscopica convenzionale e magnificata, e nell'elevata precisione e delicatezza nell’eseguire le manovre, grazie all’articolazione dei bracci robotici, che agevola - sempre rispetto le tecniche convenzionali - l’esecuzione di passaggi fini come la realizzazione delle suture.
Robot Da Vinci sutura acino d'uva
La chirurgia robotica risulta particolarmente indicata per la prostatectomia radicale perché il robot consente di raggiungere ed operare nello scavo pelvico maschile con magnificazione dell’immagine e visualizzazione tridimensionale del campo operatorio; consente di eseguire movimenti pluriarticolati con strumenti di millimetriche dimensioni in stretta vicinanza con le strutture da preservare. Questo comporta una estrema precisione dell’atto chirurgico, particolarmente importante in caso di chirurgia nerve-sparing. È indubbio anche come la robotica favorisca la realizzazione delle suture e dell’anastomosi vescico-uretrale consentendo una maggiore precisione anche nella fase ricostruttiva dell’intervento.
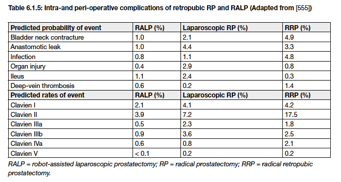
I vantaggi dell’approccio robotico più evidenti sono minore rischio di perdite ematiche peri-operatorie e minore durata della degenza. A questi si aggiunge il minore rischio di complicanze post-operatorie globali, fra cui minore rischio di infezione, di lesione ad organi adiacenti, minori problemi a carico dell’anastomosi (spandimento urinoso o stenosi). Vedi Figura 2.
Presso il nostro centro ed in collaborazione con prestigiosi centri internazionali (fra questi il Global Robotic Institute, Florida, Stati Uniti) abbiamo prestato particolare attenzione alla tecnica di chirurgia nerve -sparing ed allo studio dei risultati della tecnica chirurgica.
Selection of patients for nerve sparing surgery in robot-assisted radical prostatectomy. Vis AN, van den Bergh RCN, van der Poel HG, Mottrie A, Stricker PD, Graefen M, Patel V, Rocco B, Lissenberg-Witte B, van Leeuwen PJ.BJUI Compass. 2021 Nov 9;3(1):6-18. doi: 10.1002/bco2.115.
A Predictive Preoperative and Postoperative Nomogram for Postoperative Potency Recovery after Robot-Assisted Radical Prostatectomy. Bhat KRS, Covas Moschovas M, Sandri M, Dell'Oglio P, Onol FF, Rogers T, Reddy S, Noel J, Roof S, Sighinolfi MC, Rocco B, Patel VR.J Urol. 2021 Oct;206(4):942-951. doi: 10.1097/JU.0000000000001895.
Stratification of Potency Outcomes Following Robot-Assisted Laparoscopic Radical Prostatectomy Based on Age, Preoperative Potency, and Nerve Sparing. Bhat KRS, Covas Moschovas M, Sandri M, Reddy S, Onol FF, Noel J, Rogers T, Schatloff O, Coelho R, Ko YH, Roof S, Rocco B, Patel VR.J Endourol. 2021 Sep 27. doi: 10.1089/end.2021.0141.
Robotic-assisted radical prostatectomy in young adults: age-stratified oncological and functional outcomes. Bhat KRS, Onol FF, Moschovas MC, Reddy S, Noel J, Rogers T, Coelho R, Rocco B, Patel V.J Robot Surg. 2021 Nov 23. doi: 10.1007/s11701-021-01334-0.
A critical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. Walz J, Burnett AL, Costello AJ, Eastham JA, Graefen M, Guillonneau B, Menon M, Montorsi F, Myers RP, Rocco B, Villers A. Eur Urol. 2010 Feb;57(2):179-92. doi: 10.1016/j.eururo.2009.11.009.
Positive surgical margin during radical prostatectomy: overview of sampling methods for frozen sections and techniques for the secondary resection of the neurovascular bundles. Sighinolfi MC, Eissa A, Spandri V, Puliatti S, Micali S, Reggiani Bonetti L, Bertoni L, Bianchi G, Rocco B.BJU Int. 2020 May;125(5):656-663. doi: 10.1111/bju.15024.Nerve-sparing in salvage robot-assisted prostatectomy: surgical technique, oncological and functional outcomes at a single high-volume institution. Bonet X, Ogaya-Pinies G, Woodlief T, Hernandez-Cardona E, Ganapathi H, Rogers T, Coelho RF, Rocco B, Vigués F, Patel V.BJU Int. 2018 Nov;122(5):837-844. doi: 10.1111/bju.14517.
Retrograde Release of the Neurovascular Bundle with Preservation of Dorsal Venous Complex During Robot-assisted Radical Prostatectomy: Optimizing Functional Outcomes. de Carvalho PA, Barbosa JABA, Guglielmetti GB, Cordeiro MD, Rocco B, Nahas WC, Patel V, Coelho RF.Eur Urol. 2020 May;77(5):628-635. doi: 10.1016/j.eururo.2018.07.003.
Linfoadenectomia iliaco-otturatoria
La linfoadenectomia consiste nell’asportazione dei linfonodi loco-regionali, che sono le prime potenziali stazioni di diffusione della malattia oltre la prostata. La linfoadenectomia per tumore della prostata ha la sola funzione di consentire un’accurata stadiazione della malattia, ovvero fotografare l’estensione della stessa per impostare un trattamento adiuvante la chirurgia in caso di linfonodi positivi. La linfoadenectomia iliaco-otturatoria viene indicata per pazienti a rischio elevato di malattia e per alcuni pazienti a rischio intermedio.
In questi ultimi, la decisione se eseguire o meno la linfoadenectomia è affidata ai nomogrammi, strumenti di calcolo che in base alle caratteristiche della malattia e del paziente forniscono un rischio di coinvolgimento linfonodale e pertanto indicano la necessita di procedere o meno all’asportazione dei linfonodi loco-regionali.
Presso il nostro centro, il rischio di invasione linfonodale viene calcolato attraverso i nomogrammi sviluppati presso il Memorial Sloan Kettering Cancer Center, USA (Figura 3).
Qualora il rischio superi il 5%, il chirurgo procede a linfoadenectomia radicale robotica contestuale.
Presso il nostro centro vengono eseguiti interventi di linfoadenectomia estesa e super estesa per tumori della prostata con interessamento linfonodale già visibile agli esami di stadiazione pre-operatoria. Ho pubblicato un video sulla linfoadenectomia estesa robotica che è stato utilizzato come video educazionale dalla European School of Surgery.
Prostatectomia radicale robotica: la mia ricetta per la ripresa funzionale
Fin dai primi anni della mia carriera, mi sono dedicato a tentare di migliorare il risultato funzionale della prostatectomia radicale, affinché incontinenza urinaria e deficit erettile non siano più associati in maniera inesorabile all’intervento per carcinoma prostatico. Tutto questo, sempre nel rispetto del principio della chirurgia oncologica, cioè la radicalità e la sicurezza della completa asportazione del tumore.
Per quanto riguarda il ripristino della continenza urinaria, sono stato co-ideatore di una tecnica nota come “Punto di Rocco”, ovvero “ricostruzione posteriore del rabdomiosfintere”. La porzione posteriore dell’apparato sfinterico rappresenta una sorta di “fulcro” per la contrazione della muscolatura deputata alla continenza urinaria. Questo distretto viene interrotto con l’asportazione della prostata, creando una debolezza dell’apparato fibro-muscolare. La ricostruzione del piano posteriore consiste nell’apposizione di punti di sutura che vanno a ripristinare questo distretto, fornendo solidità e ancoraggio alla contrazione della muscolatura che evita le perdite urinarie durante il riempimento della vescica.
Il “punto di Rocco” è stato applicato inizialmente alla chirurgia a cielo aperto (2006-2007), poi alla laparoscopia ed infine alla prostatectomia robotica. Numerosi studi hanno mostrato come questa tecnica migliori in particolare modo il ripristino della continenza urinaria precoce, cioè a 1 e 3 mesi dalla rimozione del catetere vescicale. Da uno studio pubblicato nel 2013 - una survey condotta a 116 chirurghi robotici internazionali - è emerso come circa il 60% degli urologi in tutto il modo utilizzino il “Punto di Rocco” durante la prostatectomia radicale robotica.
Infine, un lavoro più recente (2017) di riassunto delle evidenze della letteratura scientifica ha mostrato come la ricostruzione posteriore sia il passaggio di tecnica chirurgica maggiormente associato al ripristino della continenza urinaria, sia precoce che nel lungo termine.
The European Association of Urology Robotic Urology Section (ERUS) survey of robot-assisted radical prostatectomy (RARP). Ficarra V, Wiklund PN, Rochat CH, Dasgupta P, Challacombe BJ, Sooriakumaran P, Siemer S, Suardi N, Novara G, Mottrie A.BJU Int. 2013 Apr;111(4):596-603. doi: 10.1111/bju.12100
Pelvic Floor Reconstruction After Radical Prostatectomy: A Systematic Review and Meta-analysis of Different Surgical Techniques. Cui J, Guo H, Li Y, Chen S, Zhu Y, Wang S, Wang Y, Liu X, Wang W, Han J, Chen P, Nie S, Yin G, Shi B.Sci Rep. 2017 Jun 2;7(1):2737. doi: 10.1038/s41598-017-02991-8
Per quanto riguarda il ripristino dell’erezione, occorre ricordare che il risparmio dei nervi (tecnica nerve sparing) può essere eseguito solo se la malattia non esce dalla capsula della prostata; infatti, se il tumore è extracapsulare e la dissezione del chirurgo decorre troppo vicino alla capsula per risparmiare i nervi, si corre il rischio di un’“infrazione” all’interno della neoplasia stessa lasciando tessuto tumorale sul margine della dissezione (margine chirurgico positivo).
Come predire quindi, prima dell’intervento, il rischio che il tumore della prostata ne superi la capsula?
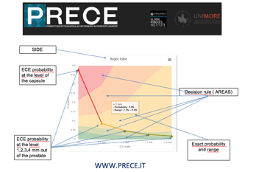
In collaborazione con il Dr Patel di Orlando, Florida, abbiamo messo a punto uno strumento predittivo di estensione extracapsulare del tumore, il PRECE (PRedicting ExtraCapsular Extension of Prostate cancer). Il PRECE è un modello predittivo (nomogramma) che si basa su informazioni semplici relative al paziente (età, PSA) ed alla sua malattia (dati relativi alla biopsia prostatica come il Gleason score); inserendo questi dati, il PRECE fornisce la percentuale di rischio che il tumore esca dalla capsula e l’esatta entità dell’estensione extracapsulare (espressa in millimetri). Questa informazione è di fondamentale importanza per il chirurgo, che manterrà la dissezione alla opportuna distanza dal profilo prostatico, asportando radicalmente la neoplasia e allo stesso tempo conservando al massimo il tessuto funzionale circostante responsabile dell’erezione.
Il PRECE è disponibile online (prece.it) ha un’interfaccia grafica di semplice utilizzo che ne consente la compilazione a cura del medico o anche del paziente stesso, in possesso dei dati relativi alla biopsia prostatica. Il PRECE indica la possibilità di potere effettuare una nerve sparing in base al rischio oncologico e consente il counselling pre-operatorio del paziente calibrandone le aspettative riguardo la ripresa della funzione sessuale (Figura 4 e 5).

Una volta pianificato il tipo di chirurgia, è utile verificare - ancora in corso di intervento - la completa asportazione del tumore.
Il controllo microscopico intra-operatorio ha una grande importanza soprattutto laddove la dissezione chirurgica sia stata condotta rasente la capsula, cioè in caso di prostatectomia nerve-sparing. Per controllare che il tumore non persista ai margini della prostata, presso il mio Centro utilizzo una tecnica innovativa di microscopia confocale (Fluorescence Confocal Microscopy) che consente la “fotografia” della superficie prostatica con possibilità di ingrandire i dettagli microscopici di interesse, cellulari e subcellulari. Il microscopio confocale è una sorta di scanner che fornisce un’immagine digitale del tessuto, che viene condivisa in remoto con il patologo per una lettura microscopica in tempo reale (Figura 6).
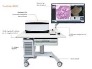
In particolare, abbiamo messo a punto una tecnica di taglio della porzione postero-laterale della prostata asportata, che può essere sede di persistenza di tumore soprattutto in caso di tecnica nerve sparing.
Il controllo microscopico consente di individuare, finche l’intervento è ancora in corso, la persistenza di tumore al margine, e quindi di estendere la dissezione chirurgica garantendo l’asportazione radicale del tumore.
Patel VR, Sandri M, Grasso AAC, De Lorenzis E, Palmisano F, Albo G, Coelho RF, Mottrie A, Harvey T, Kameh D, Palayapalayam H, Wiklund P, Bosari S, Puliatti S, Zuccolotto P, Bianchi G, Rocco B.A novel tool for predicting extracapsular extension during graded partial nervesparing in radical prostatectomy. BJU Int. 2018 Mar;121(3):373-382. doi: 10.1111/bju.14026.
Digital Frozen Sections with Fluorescence Confocal Microscopy During Robot-assisted Radical Prostatectomy: Surgical Technique. Rocco B, Sarchi L, Assumma S, Cimadamore A, Montironi R, Reggiani Bonetti L, Turri F, De Carne C, Puliatti S, Maiorana A, Pellacani G, Micali S, Bianchi G, Sighinolfi MC.Eur Urol. 2021 Dec;80(6):724-729. doi: 10.1016/j.eururo.2021.03.021
Current and future perspectives of digital microscopy with fluorescence confocal microscope for prostate tissue interpretation: a narrative review. Rocco B, Cimadamore A, Sarchi L, Bonetti LR, Bertoni L, Azzoni P, Assumma S, Turri F, Bozzini G, Eissa A, Micali S, Bianchi G, Maiorana A, Montironi R, Pellacani G, Sighinolfi MC.Transl Androl Urol. 2021 Mar;10(3):1569-1580. doi: 10.21037/tau-20-1237
Intraoperative Digital Analysis of Ablation Margins (DAAM) by Fluorescent Confocal Microscopy to Improve Partial Prostate Gland Cryoablation Outcomes. Selvaggio O, Falagario UG, Bruno SM, Recchia M, Sighinolfi MC, Sanguedolce F, Milillo P, Macarini L, Rastinehad AR, Sanchez-Salas R, Barret E, Lugnani F, Rocco B, Cormio L, Carrieri G.Cancers (Basel). 2021 Aug 30;13(17):4382. doi: 10.3390/cancers13174382
